Evaluación del aceite ozonizado y del extracto de Centella asiática en la cicatrización de heridas por escisión en ratones
Resumen
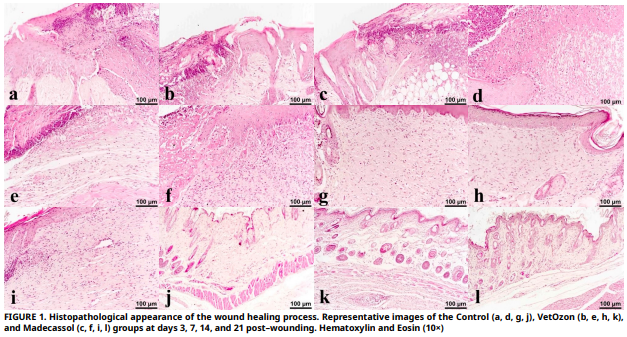
El objetivo de este estudio fue evaluar los efectos de dos tratamientos tópicos en la cicatrización de heridas en ratones BALB/c: aceite ozonizado y extracto de Centella asiática. En los días 3, 7, 14 y 21, se evaluaron la respuesta inflamatoria, la reepitelización, la deposición de colágeno y la expresión de factores de crecimiento como el factor de crecimiento endotelial vascular, el factor de crecimiento de fibroblastos y el factor de crecimiento transformante beta para evaluar la cicatrización. En comparación con el grupo control, tanto VetOzon como Madecassol presentaron una expresión marcadamente elevada de factor de crecimiento transformante beta y factor de crecimiento endotelial vascular en la primera fase. Para el día 7, sus mecanismos divergieron claramente: VetOzon indujo una respuesta inflamatoria más pronunciada, esencial para iniciar la cascada de reparación, mientras que Madecassol promovió una reepitelización y fibrosis más avanzadas. La superioridad de ambos tratamientos fue evidente en el día 14, cuando lograron una reepitelización completa, un hito que el grupo de control no había alcanzado. Notablemente, Madecassol demostró una deposición de colágeno significativamente mayor que VetOzon y el control en los días 14 y 21, lo que indica una síntesis superior de la matriz extracelular. Para el día 21, las heridas tratadas con cualquiera de los agentes mostraron una remodelación avanzada con celularidad reducida y regeneración de folículos pilosos, mientras que las heridas de control parecían estancadas en una fase de curación más temprana. En conclusión, ambos agentes aceleran eficazmente la cicatrización cutánea, pero a través de vías complementarias. VetOzon actúa como un catalizador inflamatorio de fase temprana, lo que lo hace potencialmente adecuado para heridas crónicas o infectadas, mientras que Madecassol funciona como un estimulador anabólico sostenido, posicionándolo como un agente ideal para promover una cicatrización regenerativa y de alta calidad en heridas limpias.
Descargas
Citas
Reinke JM, Sorg H. Wound repair and regeneration. Eur. Surg. Res. [Internet]. 2012; 49(1):35–43. doi: https://doi.org/f3462m DOI: https://doi.org/10.1159/000339613
Gushiken LFS, Beserra FP, Bastos JK, Jackson CJ, Pellizzon CH. Cutaneous wound healing: An update from physiopathology to current therapies. Life [Internet]. 2021; 11(7):665. doi: https://doi.org/gpzjr3 DOI: https://doi.org/10.3390/life11070665
Sorg H, Tilkorn DJ, Hager S, Hauser J, Mirastschijski U. Skin wound healing: An update on the current knowledge and concepts. Eur. Surg. Res. [Internet]. 2017; 58(1–2):81–94. doi: https://doi.org/gh2dqr DOI: https://doi.org/10.1159/000454919
Peña OA, Martin P. Cellular and molecular mechanisms of skin wound healing. Nat. Rev. Mol. Cell Biol. [Internet]. 2024; 25(8):599–616. doi: https://doi.org/gt25gn DOI: https://doi.org/10.1038/s41580-024-00715-1
Akita S. Wound repair and regeneration: Mechanisms, Signaling. Int. J. Mol. Sci. [Internet]. 2019; 20(24):6328. doi: https://doi.org/g7j69v DOI: https://doi.org/10.3390/ijms20246328
Zhang Y, Lu Q. Immune cells in skin inflammation, wound healing, and skin cancer. J. Leukoc. Biol. [Internet]. 2024; 115(5):852–865. doi: https://doi.org/qmg2 DOI: https://doi.org/10.1093/jleuko/qiad107
Rodrigues M, Kosaric N, Bonham CA, Gurtner GC. Wound healing: A cellular perspective. Physiol. Rev. [Internet]. 2019; 99(1):665–706. doi: https://doi.org/ghzzr5 DOI: https://doi.org/10.1152/physrev.00067.2017
Tyavambiza C, Meyer M, Meyer S. Cellular and molecular events of wound healing and the potential of silver based nanoformulations as wound healing agents. Bioeng. [Internet]. 2022; 9(11):712. doi: https://doi.org/qmg4 DOI: https://doi.org/10.3390/bioengineering9110712
Yuliati L, Mardliyati E, Bramono K, Freisleben HJ. Asiaticoside induces cell proliferation and collagen synthesis in human dermal fibroblasts. Universa Med. [Internet]. 2015; 34(2):96–103. doi: https://doi.org/qgts DOI: https://doi.org/10.18051/UnivMed.2015.v34.96-103
Sun B, Wu L, Wu Y, Zhang C, Qin L, Hayashi M, Kudo M, Gao, M, Liu, T. Therapeutic potential of Centella asiatica and its triterpenes: a review. Front. Pharmacol. [Internet]. 2020; 11:568032. doi: https://doi.org/gpswgv DOI: https://doi.org/10.3389/fphar.2020.568032
Anzolin A, Da Silveira–Kaross N, Bertol C. Ozonated oil in wound healing: what has already been proven? Med. Gas Res. [Internet]. 2020; 10(1):54–59. doi: https://doi.org/gp7jx5 DOI: https://doi.org/10.4103/2045-9912.279985
Brito Júnior AAD, Carneiro JKMP, Reis JVNA, Oliveira TJS, Dantas JBDL. Application of ozonized oils in human body and oral cavity systems. RGO – Rev. Gaúch. Odontol. [Internet]. 2022; 70:e20220027. doi: https://doi.org/qmg5 DOI: https://doi.org/10.1590/1981-86372022002720200152
Ugazio E, Tullio V, Binello A, Tagliapietra S, Dosio F. Ozonated oils as antimicrobial systems in topical applications. their characterization, current applications, and advances in ımproved delivery techniques. Molecules [Internet]. 2020; 25(2):334. doi: https://doi.org/gkcf6q DOI: https://doi.org/10.3390/molecules25020334
Cho K–H, Kim J–E, Bahuguna A, Kang D–J. Ozonated sunflower oil exerted potent anti–ınflammatory activities with enhanced wound healing and tissue regeneration abilities against acute toxicity of carboxymethyllysine in Zebrafish with ımproved blood lipid profile. Antioxidants [Internet]. 2023; 12(8):1625. doi: https://doi.org/qmg6 DOI: https://doi.org/10.3390/antiox12081625
Lim Y, Lee H, Woodby B, Valacchi G. Ozonated oils and cutaneous wound healing. Curr. Pharm. Des. [Internet]. 2019; 25(20):2264–2278. doi: https://doi.org/g9mvfw DOI: https://doi.org/10.2174/1381612825666190702100504
Ruiz–Vall A, Altamirano–Faus A, Bedmar–Gonzalez N, Andres– Lencina JJ. Improvement of surgical wound healing with ozonated oil in bilateral breast surgery: A pilot ıntra–patient comparative study. Cureus [Internet]. 2025; 17(6):e85829. doi: https://doi.org/qmg7 DOI: https://doi.org/10.7759/cureus.85829
Xiao W, Tang H, Wu M, Liao Y, Li K, Li L, Xu X. Ozone oil promotes wound healing by increasing the migration of fibroblasts via PI3K/Akt/mTOR signaling pathway. Biosci. Rep. [Internet]. 2017; 37(6):BSR20170658. doi: https://doi.org/fz27 DOI: https://doi.org/10.1042/BSR20170658
Ginel PJ, Negrini J, Guerra R, Lucena R, Ruiz–Campillo MT, Mozos E. Effect of topical ozonated sunflower oil on second intention wound healing in turtles: a randomised experimental study. J. Vet. Sci. [Internet]. 2021; 22(2):e27. doi: https://doi.org/qmg8 DOI: https://doi.org/10.4142/jvs.2021.22.e27
Van De Vyver M, Boodhoo K, Frazier T, Hamel K, Kopcewicz M, Levi B, Maartens M, Machcinska S, Nunez J, Pagani C, Rogers E, Walendzik K, Wisniewska J, Gawronska–Kozak B, Gimble JM. Histology scoring system for murine cutaneous wounds. Stem Cells Dev. [Internet]. 2021; 30(23):1141–1152. doi: https://doi.org/gqp5b6 DOI: https://doi.org/10.1089/scd.2021.0124
Wilkinson HN, Hardman MJ. Wound healing: cellular mechanisms and pathological outcomes. Open Biol. [Internet]. 2020; 10(9):200223. doi: https://doi.org/gpqrtv DOI: https://doi.org/10.1098/rsob.200223
Togi S, Togi M, Nagashima S, Kitai Y, Muromoto R, Kashiwakura J, Miura T, Matsuda T. Implication of NF–κB activation on ozone–ınduced HO–1 activation. BPB Rep. [Internet]. 2021; 4(2):59–63. doi: https://doi.org/qmg9 DOI: https://doi.org/10.1248/bpbreports.4.2_59
Gunawan ES, Budiono BP. Enhancing the early inflammatory response: The role of ozonated Aloe vera oil on IL–6 and TNF–α in cutaneous wound repair. Biosci. Med. J. Biomed. Transl. Res. [Internet]. 2025; 9(9):2852–2865. doi: https://doi.org/qmhb DOI: https://doi.org/10.37275/bsm.v9i9.1380
Ozdemir O, Ozkan K, Hatipoglu F, Uyaroglu A, Arican M. Effect of asiaticoside, collagenase, and alpha–chymotrypsin on wound healing in rabbits. Wounds [Internet]. 2016 [cited Aug 20, 2025]; 28(8):279–286. Available in: https://goo.su/xq9Y
Mamun AA, Shao C, Geng P, Wang S, Xiao J. Recent advances in molecular mechanisms of skin wound healing and its treatments. Front. Immunol. [Internet]. 2024; 15:1395479. doi: https://doi.org/g8qdxd DOI: https://doi.org/10.3389/fimmu.2024.1395479
Singh D, Rai V, Agrawal DK. Regulation of collagen I and collagen III in tissue injury and regeneration. Cardiol. Cardiovasc. Med. [Internet], 2023; 7(1):5–16. doi: https://doi.org/g86n33
Budi EH, Schaub JR, Decaris M, Turner S, Derynck R. TGF–β as a driver of fibrosis: physiological roles and therapeutic opportunities. J. Pathol. [Internet]. 2021; 254(4):358–373. doi: https://doi.org/gphpf8 DOI: https://doi.org/10.1002/path.5680
Shi Z, Yao C, Shui Y, Li S, Yan H. Research progress on the mechanism of angiogenesis in wound repair and regeneration. Front. Physiol, 2023; 14:1284981. doi: https://doi.org/qmhc DOI: https://doi.org/10.3389/fphys.2023.1284981