Composición fitoquímica comparativa y bioactividades de la variedad local de Prunus domestica L. del noreste de Turquía
Resumen
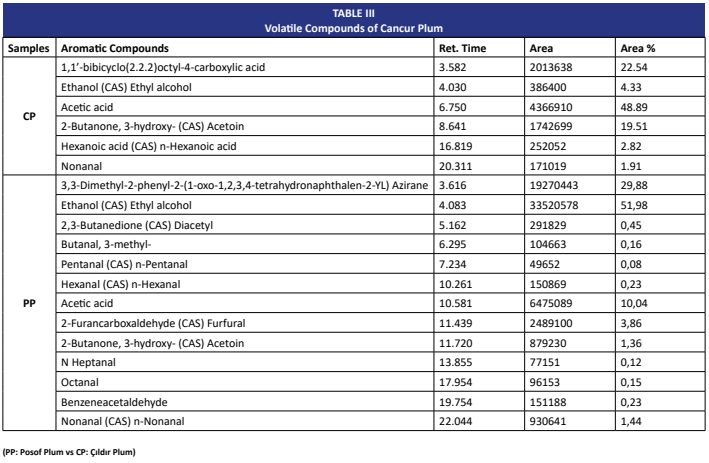
La ciruela Cancur (Prunus domestica L.), una variedad local cultivada en el noreste de Turquía, es una valiosa fuente de compuestos bioactivos con posibles aplicaciones en alimentos funcionales. Este estudio tuvo como objetivo evaluar exhaustivamente la composición fitoquímica y las propiedades funcionales de los frutos de la ciruela Cancur recolectados en dos regiones con condiciones climáticas contrastantes: Posof (microclima, 1260 m) y Çıldır (clima continental, 1585 m). El potencial antioxidante se evaluó mediante diversos enfoques, incluyendo los ensayos de TAC, DPPH, glutatión, SOD y catalasa, mientras que también se determinaron las cantidades de fenoles totales, flavonoides y antocianinas. Los compuestos fenólicos y flavonoides se identificaron mediante LC-MS/MS, los perfiles de volátiles se determinaron mediante GC-MS y el contenido de azúcares libres se analizó mediante HPLC. Los resultados revelaron que las muestras de Çıldır mostraron una actividad de depuración de DPPH y niveles de catalasa significativamente mayores, mientras que las muestras de Posof presentaron un mayor contenido de fenoles totales y concentraciones de glutatión. Ambas muestras mostraron una capacidad antioxidante total comparable, aunque a través de diferentes vías bioquímicas. El análisis LC-MS/MS reveló que los ácidos shikímico, clorogénico y p-cumárico eran los fenólicos predominantes en la muestra de Çıldır, mientras que la rutina y la hesperidina fueron más abundantes. El perfil GC-MS destacó el ácido acético y la acetoína como los principales volátiles en la muestra de Çıldır, mientras que el etanol y el furfural predominaron en la muestra de Posof. La glucosa y la fructosa se identificaron como los azúcares primarios, mientras que solo se detectaron pequeñas cantidades de sacarosa en las frutas de Çıldır. Las diferencias microclimáticas influyen fuertemente en los perfiles bioquímicos y funcionales de la ciruela Cancur, resaltando su valor como fuente de antioxidantes, compuestos de sabor e ingredientes alimentarios funcionales.
Descargas
Citas
Oz AT, Kafkas E. Phytochemicals in Fruits and Vegetables. In: Waisundara V, Shiomi N, (editors). Superfood Funct. Food Process. Util. InTech. [Internet]. 2017; 8:175-184. doi: https://doi.org/qg56 DOI: https://doi.org/10.5772/66987
Hashim MS, Lincy S, Remya V, Teena M, Anila L. Effect of polyphenolic compounds from Coriandrum sativum on H2O2-induced oxidative stress in human lymphocytes. Food Chem. [Internet]. 2005; 92(4):653-660. doi: https://doi.org/bpk94r DOI: https://doi.org/10.1016/j.foodchem.2004.08.027
Lima GPP, Vianello F, Corrêa CR, da Silva Campos RA, Borguini MG. Polyphenols in Fruits and Vegetables and Its Effect on Human Health. Food Nutr. Sci. [Internet]. 2014; 5(11):1065-1082. doi: https://doi.org/qg57 DOI: https://doi.org/10.4236/fns.2014.511117
Kristl J, Slekovec M, Tojnko S, Unuk T. Extractable antioxidants and non-extractable phenolics in the total antioxidant activity of selected plum cultivars (Prunus domestica L.): Evolution during on-tree ripening. Food Chem. [Internet]. 2011; 125(1):29-34. doi: https://doi.org/dcs68v DOI: https://doi.org/10.1016/j.foodchem.2010.08.027
Rop O, Jurikova T, Mlcek J, Kramarova D, Sengee Z. Antioxidant activity and selected nutritional values of plums (Prunus domestica L.) typical of the White Carpathian Mountains. Sci. Hortic. [Internet]. 2009; 122(4):545-549. doi: https://doi.org/ct4gcb DOI: https://doi.org/10.1016/j.scienta.2009.06.036
Rupasinghe HPV, Jayasankar S, Lay W. Variation in total phenolics and antioxidant capacity among European plum genotypes. Sci. Hortic. [Internet]. 2006; 108(3):243-246. doi: https://doi.org/fxhfnd DOI: https://doi.org/10.1016/j.scienta.2006.01.020
Gonzáles-García E, Marina ML, Concepción García M. Plum (Prunus domestica L.) by-Product as a New and Cheap Source of Bioactive Peptides: Extraction Method and Peptites Characterization. J. Funct. Foods. [Internet]. 2014; 11:428-437. doi: https://doi.org/f6t5vc DOI: https://doi.org/10.1016/j.jff.2014.10.020
Murathan ZT, Arslan M, Erbil N. Analyzing Biological Properties of Some Plum Genotypes Grown in Turkey. Int. J. Fruit Sci. [Internet]. 2020; 20(3):S1729-S1740. doi: https://doi.org/qg58 DOI: https://doi.org/10.1080/15538362.2020.1830917
Blois MS. Antioxidant determination by the use of a stable free radical. Nature. [Internet]. 1958; 181:1199- 1200. doi: https://doi.org/bdq98t DOI: https://doi.org/10.1038/1811199a0
Sedlak J, Lindsay RH. Estimation of total, protein-bound, and nonprotein sulfhydryl groups in tissue with Ellman’s reagent. Anal. Biochem. [Internet]. 1968; 25(1):192-205. doi: https://doi.org/csbsfm DOI: https://doi.org/10.1016/0003-2697(68)90092-4
Spanos GA, Wrolstad RE. Phenolics of Apple, Pear, and White Grape Juices and Their Changes with Processing and Storage - a Review. J. Agric Food Chem. [Internet]. 1992; 40(9):1478-1487. doi: https://doi.org/b27dmg DOI: https://doi.org/10.1021/jf00021a002
Quettier-Deleu C, Gressier B, Vasseur J, Dine T, Brunet C, Luyckx M, Cazin M, Cazin JC, Bailleul F, Trotin F. Phenolic compounds and antioxidant activities of buckwheat (Fagopyrum esculentum Moench) hulls and flour. J. Ethnopharmacol. [Internet]. 2000; 72(1-2):35-42. doi: https://doi.org/ft249d DOI: https://doi.org/10.1016/S0378-8741(00)00196-3
Garzón GA, Wrolstad RE. The stability of pelargonidin- based anthocyanins at varying water activity. Food Chem. [Internet]. 2001; 75(2):185-196. doi: https://doi.org/bdgkq5 DOI: https://doi.org/10.1016/S0308-8146(01)00196-0
Gonçalves B, Oliveira I, Bacelar E, Morais MC, Aires A, Cosme F, Ventura-Cardoso J, Anjos R, Pinto T. Aromas and Flavours of Fruits. In: Vilela A, editor. Generation of Aromas and Flavours. Rijeka: IntechOpen. 2018; 2:9-31. https://doi.org/gpx6qr DOI: https://doi.org/10.5772/intechopen.76231
Sánchez-Rodríguez L, Ali NS, Cano-Lamadrid M, Noguera- Artiaga L, Lipan L, Carbonell-Barrachina ÁA, Sendra E. - Flavors and Aromas. In: Yahia EM, editor. Postharvest Physiology and Biochemistry of Fruits and Vegetables. Chapter 18. Cambridge, Inglaterra: Woodhead Publishing; 2019. p. 385-404. doi: https://doi.org/gjvq89 DOI: https://doi.org/10.1016/B978-0-12-813278-4.00019-1
Aragüez I, Valpuesta-Fernández V. Metabolic engineering of aroma components in fruits. Biotechnol. J. [Internet]. 2013; 8(10):1144-1158. doi: https://doi.org/f2dv49 DOI: https://doi.org/10.1002/biot.201300113
Du M, Zhu Y, Nan H, Zhou Y, Pan X. Regulation of sugar metabolism in fruits. Sci. Hortic. [Internet]. 2024; 326:112712. doi: https://doi.org/g8rk6p DOI: https://doi.org/10.1016/j.scienta.2023.112712
Pashaei M, Hassanpour H. Phenolic, amino acids, and fatty acids profiles and the nutritional properties in the fresh and dried fruits of black rosehip (Rosa pimpinellifolia L.). Sci. Rep. [Internet]. 2024; 14(1):19665. doi: https://doi.org/qg6b DOI: https://doi.org/10.1038/s41598-024-70574-5
Kafkas E, Kosar M, Türemis N, Baser KHC. Analysis of sugars, organic acids and vitamin C contents of blackberry genotypes from Turkey. Food Chem. [Internet]. 2006; 97(4):732-736. doi: https://doi.org/c8jjfp DOI: https://doi.org/10.1016/j.foodchem.2005.09.023
Celik F, Gundogdu M, Alp S, Muradoglu F, Ercisli S, Gecer MK, Canan I. Determination of Phenolic Compounds, Antioxidant Capacity and Organic Acids Contents of Prunus domestica L., Prunus cerasifera Ehrh. and Prunus spinosa L. Fruits by HPLC. Acta Chromatogr. [Internet]. 2017; 29(4):507-510. doi: https://doi.org/qg6c DOI: https://doi.org/10.1556/1326.2017.00327
Sahoo A, Sarkar S, Lal B, Kumawat P, Sharma S, De K. Utilization of Fruit and Vegetables Waste as an Alternative Feed Resource for Sustainable and Eco-Friendly Sheep Farming. Waste Manag. [Internet]. 2021; 128:232-242. doi: https://doi.org/gj3gs DOI: https://doi.org/10.1016/j.wasman.2021.04.050